È noto da tempo che tutte le molecole possiedono due cariche uguali e opposte che sono separate da una certa distanza. Nel caso di tali molecole polari, il centro di carica negativa non coincide con il centro di carica positiva. L'entità della polarità in tali molecole covalenti può essere descritta dal termine momento dipolo, che è essenzialmente la misura della polarità in un legame covalente polare.
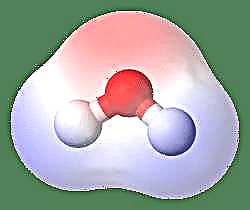
L'esempio più semplice di un dipolo è una molecola d'acqua. Una molecola di acqua è polare a causa della condivisione ineguale dei suoi elettroni in una struttura "piegata". La molecola d'acqua forma un angolo, con atomi di idrogeno sulla punta e ossigeno al vertice. Poiché l'ossigeno ha una elettronegatività maggiore dell'idrogeno, il lato della molecola con l'atomo di ossigeno ha una carica negativa parziale mentre l'idrogeno, al centro, ha una carica positiva parziale. Per questo motivo, la direzione del momento dipolo punta verso l'ossigeno.
Nel linguaggio della fisica, il momento del dipolo elettrico è una misura della separazione delle cariche elettriche positive e negative in un sistema di cariche, cioè una misura della polarità complessiva del sistema di carica - cioè la separazione della carica elettrica delle molecole, che porta a un dipolo. Matematicamente, e nel caso semplice di due cariche punti, una con carica + q e una con carica? Q, il momento dipolo elettrico p può essere espresso come: p = qd, dove d è il vettore di spostamento che punta dalla carica negativa a la carica positiva. Pertanto, il vettore del momento di dipolo elettrico p punta dalla carica negativa alla carica positiva.
Un altro modo di vederlo è quello di rappresentare il momento dipolo con la lettera greca m, m = ed, dove e è la carica elettrica e d è la distanza di separazione. È espresso nelle unità di Debye e scritto come D (dove 1 Debye = 1 x 10-18e.s.u cm). Un momento dipolo è una quantità vettoriale ed è quindi rappresentato da una piccola freccia con una coda al centro positivo e la testa che punta verso un centro negativo. Nel caso di una molecola di acqua, il momento del dipolo è 1,85 D, mentre una molecola di acido cloridrico è 1,03 D e può essere rappresentata come:
Abbiamo scritto molti articoli sul momento di dipolo per Space Magazine. Ecco un articolo sulla composizione dell'acqua e un articolo sulle molecole.
Se desideri maggiori informazioni sul momento dipolo, consulta questi articoli da Hyperphysics e Science Daily.
Abbiamo anche registrato un intero episodio di Astronomy Cast tutto su Molecules in Space. Ascolta qui, Episodio 116: Molecules in Space.
fonti:
http://en.wikipedia.org/wiki/Electric_dipole_moment
http://en.wikipedia.org/wiki/Dipole
http://www.tutorvista.com/content/chemistry/chemistry-iii/chemical-bonding/degree-polarity.php
http://hyperphysics.phy-astr.gsu.edu/hbase/electric/dipole.html#c1
http://en.wikipedia.org/wiki/Water_molecule