Il cambiamento segue la valutazione della FDA dei rapporti che descrivono incidenti "rari ma gravi" che si sono verificati quando gli utenti di questi farmaci hanno sperimentato comportamenti del sonno complessi: sonnambulismo, guida del sonno "e impegnarsi in altre attività mentre non sono completamente svegli", hanno scritto ieri i rappresentanti della FDA (30 aprile ) in un annuncio sulla sicurezza dei farmaci.
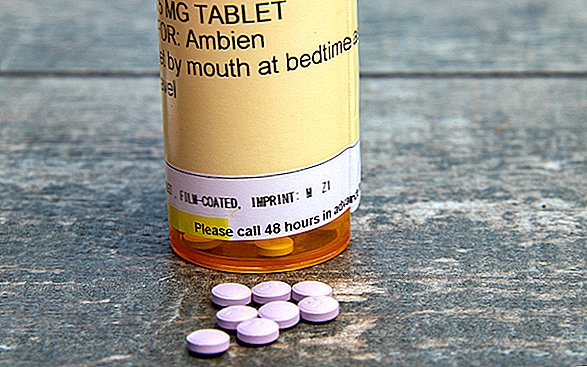
Un avviso in scatola apparirà ora sulle guide ai farmaci dei pazienti e sulle informazioni di prescrizione per i farmaci per l'insonnia come Ambien (nome generico zolpidem), Sonata (nome generico zaleplon), Lunesta (nome generico eszopiclone) e altri, secondo l'annuncio.
Un altro degli avvertimenti più rigorosi della FDA - una controindicazione, che raccomanda di evitare un farmaco in determinate condizioni - sarà anche incluso, consigliando alle persone che hanno già sperimentato comportamenti di sonno complessi durante l'uso di questi farmaci per interrompere l'uso.
La FDA ha studiato dati che durano 26 anni e ha trovato 66 esempi di comportamenti del sonno complessi associati a questi farmaci. I pazienti hanno eseguito azioni che hanno portato a ipotermia o perdita di arti dopo l'esposizione a freddo estremo; ci sono stati casi di avvelenamento da monossido di carbonio, annegamento, apparenti tentativi di suicidio, ferite da arma da fuoco auto-inflitte e incidenti d'auto - con il paziente al volante.
Nella maggior parte dei casi, i pazienti non ricordavano nemmeno gli incidenti che hanno portato alle loro ferite, secondo la FDA.
Poiché questi risultati si basavano solo su casi clinici nella letteratura medica e su account inviati direttamente alla FDA, è possibile che ci siano ancora più esempi di lesioni da comportamenti del sonno complessi che non sono stati documentati, hanno detto i funzionari della FDA.
Milioni di americani soffrono di insonnia e fanno affidamento sui farmaci per aiutarli a dormire, ma "è importante che i pazienti e gli operatori sanitari siano consapevoli del rischio", ha dichiarato il commissario alla FDA Dr. Ned Sharpless in una nota.
"Questi incidenti possono verificarsi dopo la prima dose di questi medicinali per il sonno o dopo un periodo più lungo di trattamento e possono verificarsi in pazienti senza alcuna storia di questi comportamenti e anche alle dosi più basse raccomandate", ha detto Sharpless.
I funzionari della FDA non hanno capito bene come questi farmaci scatenino comportamenti complessi del sonno che possono causare lesioni. L'agenzia continuerà a monitorare i farmaci per l'insonnia e a valutare i rischi ad essi associati, per determinare se saranno necessarie ulteriori azioni, ha affermato il dott. Janet Woodcock, direttore del Centro per la valutazione e la ricerca sui farmaci della FDA.