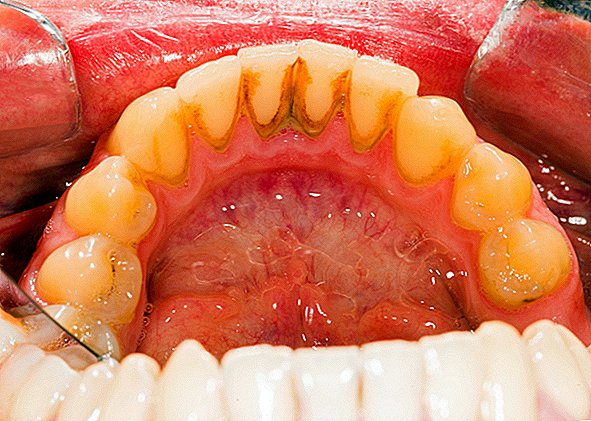
I biofilm sono un collettivo di uno o più tipi di microrganismi che possono crescere su molte superfici diverse. I microrganismi che formano i biofilm includono batteri, funghi e protisti.
Un esempio comune di una placca dentale a biofilm, un viscido accumulo di batteri che si forma sulla superficie dei denti. La feccia dello stagno è un altro esempio. Sono stati trovati biofilm che crescono su minerali e metalli. Sono stati trovati sott'acqua, sottoterra e sopra il suolo. Possono crescere su tessuti vegetali e tessuti animali e su dispositivi medici impiantati come cateteri e pacemaker.
Ognuna di queste superfici distinte ha una caratteristica comune: sono bagnate. Questi ambienti sono "periodicamente o continuamente impregnati di acqua", secondo un articolo del 2007 pubblicato sulla rivista Microbe. I biofilm prosperano su superfici umide o bagnate.
I biofilm si sono affermati in tali ambienti per molto tempo. Le prove fossili di biofilm risalgono a circa 3,25 miliardi di anni fa, secondo un articolo del 2004 pubblicato sulla rivista Nature Reviews Microbiology. Ad esempio, sono stati trovati biofilm nelle rocce idrotermali di acque profonde di 3,2 miliardi di anni fa del Pilbara Craton in Australia. Biofilm simili si trovano in ambienti idrotermali come sorgenti termali e sfoghi di acque profonde.

Formazione di biofilm
La formazione del biofilm inizia quando i microrganismi a galleggiamento libero come i batteri entrano in contatto con una superficie appropriata e iniziano a mettere radici, per così dire. Questa prima fase dell'attaccamento si verifica quando i microrganismi producono una sostanza appiccicosa nota come sostanza polimerica extracellulare (EPS), secondo il Center for Biofilm Engineering della Montana State University. Un EPS è una rete di zuccheri, proteine e acidi nucleici (come il DNA). Permette ai microrganismi in un biofilm di aderire.
L'attaccamento è seguito da un periodo di crescita. Ulteriori strati di microrganismi e EPS si basano sui primi strati. Alla fine, creano una struttura 3D bulbosa e complessa, secondo il Center for Biofilm Engineering. I canali idrici attraversano i biofilm e consentono lo scambio di nutrienti e prodotti di scarto, secondo l'articolo di Microbe.
Molteplici condizioni ambientali aiutano a determinare fino a che punto cresce un biofilm. Questi fattori determinano anche se è composto da pochi strati di cellule o significativamente più. "Dipende molto dal biofilm", ha affermato Robin Gerlach, professore nel dipartimento di ingegneria chimica e biologica presso la Montana State University-Bozeman. Ad esempio, i microrganismi che producono una grande quantità di EPS possono trasformarsi in biofilm abbastanza spessi anche se non hanno accesso a molti nutrienti, ha affermato. D'altra parte, per i microrganismi che dipendono dall'ossigeno, la quantità disponibile può limitare quanto possono crescere. Un altro fattore ambientale è il concetto di "stress da taglio". "Se hai un flusso molto elevato attraverso un biofilm, come in un torrente, il biofilm è di solito abbastanza sottile. Se hai un biofilm in acqua a flusso lento, come in uno stagno, può diventare molto denso", ha spiegato Gerlach.
Infine, le cellule all'interno di un biofilm possono lasciare la piega e stabilirsi su una nuova superficie. O un gruppo di cellule si rompe o singole cellule esplodono dal biofilm e cercano una nuova casa. Quest'ultimo processo è noto come "dispersione della semina", secondo il Center for Biofilm Engineering.
Perché formare un biofilm?
Per i microrganismi, vivere come parte di un biofilm presenta alcuni vantaggi. "Le comunità di microbi sono generalmente più resistenti allo stress", ha detto Gerlach a Live Science. I potenziali fattori di stress includono la mancanza di acqua, pH alto o basso o la presenza di sostanze tossiche per i microrganismi come antibiotici, antimicrobici o metalli pesanti.
Ci sono molte possibili spiegazioni per la resistenza dei biofilm. Ad esempio, il rivestimento viscoso in EPS può fungere da barriera protettiva. Può aiutare a prevenire la disidratazione o fungere da scudo contro la luce ultravioletta (UV). Inoltre, sostanze nocive come antimicrobici, candeggina o metalli vengono legate o neutralizzate quando entrano in contatto con l'EPS. Pertanto, sono diluiti a concentrazioni che non sono letali prima che possano raggiungere varie cellule in profondità nel biofilm, secondo un articolo del 2004 su Nature Reviews Microbiology.
Tuttavia, alcuni antibiotici possono penetrare nell'EPS e farsi strada attraverso gli strati di un biofilm. Qui può entrare in gioco un altro meccanismo protettivo: la presenza di batteri che sono fisiologicamente dormienti. Per funzionare bene, tutti gli antibiotici richiedono un certo livello di attività cellulare. Quindi, se i batteri sono fisiologicamente dormienti per cominciare, non c'è molto da interrompere per un antibiotico.
Un altro modo di protezione dagli antibiotici è la presenza di speciali cellule batteriche note come "persecuzioni". Tali batteri non si dividono e sono resistenti a molti antibiotici. Secondo un articolo del 2010 pubblicato sulla rivista Cold Spring Harbor Perspectives in Biology, "persegue" la funzione producendo sostanze che bloccano gli obiettivi degli antibiotici.
In generale, i microrganismi che vivono insieme come biofilm beneficiano della presenza dei loro vari membri della comunità. Gerlach ha citato l'esempio dei microrganismi autotrofi ed eterotrofi che convivono nei biofilm. Gli autotrofi, come i batteri fotosintetici o le alghe, sono in grado di produrre il proprio cibo sotto forma di materiale organico (contenente carbonio), mentre gli eterotrofi non possono produrre il proprio cibo e richiedono fonti esterne di carbonio. "In queste comunità multi-organismatiche, spesso si incrociano", ha detto.
Biofilms e noi
Data la vasta gamma di ambienti in cui incontriamo i biofilm, non sorprende che influenzino molti aspetti della vita umana. Di seguito sono riportati alcuni esempi.

Salute e malattia
Con il progredire della ricerca nel corso degli anni, i biofilm - batterici e fungini - sono stati implicati in una varietà di condizioni di salute. In una richiesta del 2002 per le domande di sovvenzione, il National Institutes of Health (NIH) ha osservato che i biofilm rappresentavano "oltre l'80% delle infezioni microbiche nel corpo".
I biofilm possono crescere su dispositivi medici impiantati come valvole cardiache protesiche, protesi articolari, cateteri e pacemaker. Questo a sua volta porta a infezioni. Il fenomeno fu notato per la prima volta negli anni '80, quando furono trovati biofilm batterici su cateteri e pacemaker endovenosi. È stato anche noto che i biofilm batterici causano endocardite infettiva e polmonite in quelli con fibrosi cistica, secondo l'articolo del 2004 su Nature Reviews Microbiology, tra le altre infezioni.
"La ragione per cui la formazione di biofilm è una grande causa di preoccupazione è che, all'interno di un biofilm, i batteri sono più resistenti agli antibiotici e ad altri importanti disinfettanti che potresti usare per controllarli", ha affermato AC Matin, professore di microbiologia e immunologia a Stanford Università. Infatti, rispetto ai batteri che galleggiano liberamente, quelli che crescono come biofilm possono essere fino a 1.500 volte più resistenti agli antibiotici e ad altri agenti biologici e chimici, secondo l'articolo di Microbe. Matin ha descritto la resistenza al biofilm combinata con l'aumento generale della resistenza agli antibiotici tra i batteri come un "doppio smorfia" e una grande sfida per il trattamento delle infezioni.
I biofilm fungini possono anche causare infezioni crescendo su dispositivi impiantati. Specie di lievito come i membri del genere Candida crescere su protesi mammarie, pacemaker e valvole cardiache protesiche secondo un articolo del 2014 pubblicato sulla rivista Cold Spring Harbor Perspectives in Medicine. Candida le specie crescono anche sui tessuti del corpo umano, portando a malattie come la vaginite (infiammazione della vagina) e la candidosi orofaringea (un'infezione da lievito che si sviluppa nella bocca o nella gola). Tuttavia, gli autori notano che la resistenza ai farmaci non è stata dimostrata in questi casi.
Biorimedio
A volte, i biofilm sono utili. "La biorisanamento, in generale, è l'uso di organismi viventi o dei loro prodotti - ad esempio enzimi - per trattare o degradare i composti nocivi", ha detto Gerlach. Ha osservato che i biofilm vengono utilizzati nel trattamento delle acque reflue, contaminanti da metalli pesanti come il cromato, esplosivi come il TNT e sostanze radioattive come l'uranio. "I microbi possono degradarli o cambiare la loro mobilità o il loro stato tossico e quindi renderli meno dannosi per l'ambiente e per l'uomo", ha detto.
La nitrificazione mediante biofilm è una forma di trattamento delle acque reflue. Durante la nitrificazione, l'ammoniaca viene convertita in nitriti e nitrati attraverso l'ossidazione. Questo può essere fatto da batteri autotrofi, che crescono come biofilm su superfici di plastica, secondo un articolo del 2013 pubblicato sulla rivista Water Research. Queste superfici in plastica hanno dimensioni di pochi centimetri e sono distribuite in tutta l'acqua.
Il TNT esplosivo (2,4,6-Trinitrotoluene) è considerato un inquinante del suolo, delle acque superficiali e sotterranee. La struttura chimica di TNT è costituita da benzene (un anello aromatico esagonale composto da sei atomi di carbonio) attaccato a tre gruppi nitro (NO2) e un gruppo metilico (CH3). I microrganismi degradano il TNT per riduzione, secondo un articolo del 2007 pubblicato sulla rivista Applied and Environmental Microbiology. La maggior parte dei microrganismi riduce i tre gruppi nitro, mentre alcuni attaccano l'anello aromatico. I ricercatori - Ayrat Ziganshin, Robin Gerlach e colleghi - hanno scoperto che la tensione del lievito Yarrowia lipolytica è stato in grado di degradare il TNT con entrambi i metodi, sebbene principalmente attaccando l'anello aromatico.
Celle a combustibile microbiche
Le celle a combustibile microbiche usano i batteri per convertire i rifiuti organici in elettricità. I microbi vivono sulla superficie di un elettrodo e trasferiscono elettroni su di esso, creando alla fine una corrente, ha detto Gerlach. Un articolo del 2011 pubblicato su Illumin, una rivista online dell'Università della California del Sud, osserva che i batteri che alimentano le celle a combustibile microbiche distruggono il cibo e i rifiuti corporei. Ciò fornisce una fonte di energia a basso costo e un'energia pulita e sostenibile.
Ricerche in corso
Il nostro mondo pullula di biofilm. Infatti, verso la metà del 20 ° secolo, sono stati trovati più batteri sulle superfici interne dei contenitori che contengono colture batteriche, che galleggiano liberamente nella stessa cultura liquida, secondo l'articolo del 2004 su Nature Reviews Microbiology. Comprendere queste complesse strutture microbiche è un'area attiva di ricerca.
"I biofilm sono comunità straordinarie. Alcune persone li hanno confrontati con organismi multicellulari perché c'è molta interazione tra singole cellule", ha detto Gerlach. "Stiamo continuando a conoscerli e stiamo continuando a imparare come controllarli meglio; sia per ridurre il danno, come nel campo della medicina, sia per aumentare i benefici come nel biorisanamento. Non finiremo domande interessanti in quella zona ".